Temps de lecture : 9 minutes
L’ADN et l’ensemble des gènes qu’il contient codent uniquement pour des protéines. Tout ce qui est inscrit dans l’ADN est transcrit par l’ARN polymérase en ARN messager, puis traduit par les ribosomes en une chaîne d’acides aminés, formant ainsi une protéine non encore conformée. Considérées comme le troisième maillon de la chaîne d’expression du code génétique, les protéines sont indispensables à la structure et au bon fonctionnement de nos cellules. Ces protéines n’acquièrent leur fonctionnalité qu’en adoptant un repliement tridimensionnel précis. Une altération de cette structure entraîne une perte de fonction ou des agrégations pathologiques, d’où l’importance des protéines chaperonnes, comme les HSPs, qui assurent le maintien et la correction du bon repliement.
Les chaperonnes, protéines de choc HSPs (Heat Shock Proteins) sont des protéines qui permettent à nos cellules de lutter contre le stress cellulaire et jouent aussi un rôle dans les défenses de l’organisme en préservant la forme tridimensionnelle des protéines et en éliminant les protéines irrémédiablement endommagées.
L’origine d’un stress cellulaire, situation dans laquelle une cellule est exposée à des conditions défavorables sublétals menaçant son équilibre interne (homéostasie), est variée. Elle peut être nutritionnelle, biochimique, bactériologique, virale, thermique, ou encore environnementale et altère le repliement des protéines et en cela les fonctions cellulaires.
En conséquence de ce stress, les protéines, modifient leur forme tridimensionnelle et en conséquence, altèrent leur fonction. Les processus cellulaires se trouvent entravés ou simplement ralenti ce qui provoque une accumulation de stress par l’accroissement des radicaux libres, des déchets cellulaires et de facteurs complétant le stress. Ce cercle vicieux accentue le stress cellulaire et épuise progressivement la capacité des cellules à maintenir le bon fonctionnement de leurs processus vitaux.
Pour tenter de rétablir son équilibre, la cellule active divers mécanismes de protection et de réparation, tels que l’induction des protéines de choc thermique, les systèmes antioxydants, la réparation de l’ADN ou encore l’autophagie. Son objectif sera de restaurer l’homéostasie et d’assurer sa survie. Toutefois, si les dommages dépassent les capacités d’adaptation par restauration de la conformation ou élimination des protéines trop endommagées, la cellule entrera en apoptose (mort programmée par disparition du noyau mais persistance des fonctionnalités du cytoplasme).
Le mécanisme cellulaire d’induction des protéines de choc thermique est commun à presque tous les organismes, des bactéries aux champignons, en passant par les plantes et les animaux, y compris les êtres humains et est donc hautement conservé au cours de l’évolution.
Les HSPs jouent un rôle crucial dans le maintien du fonctionnement de l’intégrité cellulaire. Elles évitent les interactions moléculaires indésirables et favorisent celles qui sont souhaitables.
La découverte des HSPs date de 1962, à l’Institut de génétique de Pavie, en Italie, lorsque quelqu’un augmenta par inadvertance la température d’un incubateur contenant des drosophiles. Lorsque le généticien Ferruccio Ritossa examina les cellules des insectes ayant subi un tel « choc thermique », il remarqua que leurs chromosomes avaient enflé par endroits : des gènes avaient été activés dans ces régions et des protéines synthétisées. Des protéines, nommés Heat Shock Proteins HSPs, ont donc été produites en réponse à une condition stressante afin d’éviter toute dénaturation et garantir la bonne conformation des protéines dans la cellule.
Les protéines de choc thermique (HSPs) sont classées et désignées selon leur localisation cellulaire, leur mode d’expression et surtout leur poids moléculaire. Ainsi, les familles Hsp60, Hsp70 et Hsp90, parmi les plus étudiées, correspondent respectivement à des protéines d’environ 60, 70 et 90 kDa (kilo-Dalton où 1 kDa est environ égal à 1 000g/mole).
Une petite protéine de 8 kDa, l’ubiquitine, impliquée dans le marquage des protéines destinées à la dégradation, présente également des caractéristiques typiques des protéines de choc thermique. Ce type de petites HSPs contiennent parfois un domaine de liaison aux protéines, dit « alpha-crystalline », constitué d’environ 80 acides aminés (un peptide de 80 acides aminés aura environ une masse moléculaire de 80×110/1000 = 8,8 kDa).
On distingue généralement plusieurs classes de HSPs, nommées ainsi d’après leur masse moléculaire Hsp100 ; Hsp90 ; Hsp70 ; Hsp60 ; Hsp40 ; Hsp de 20 à 30 kDa et Hsp10.
Les HSPs agissent comme des chaperons moléculaires dont les principales fonctions peuvent se résumer ainsi :
Transport des fragments de protéines nouvellement synthétisés
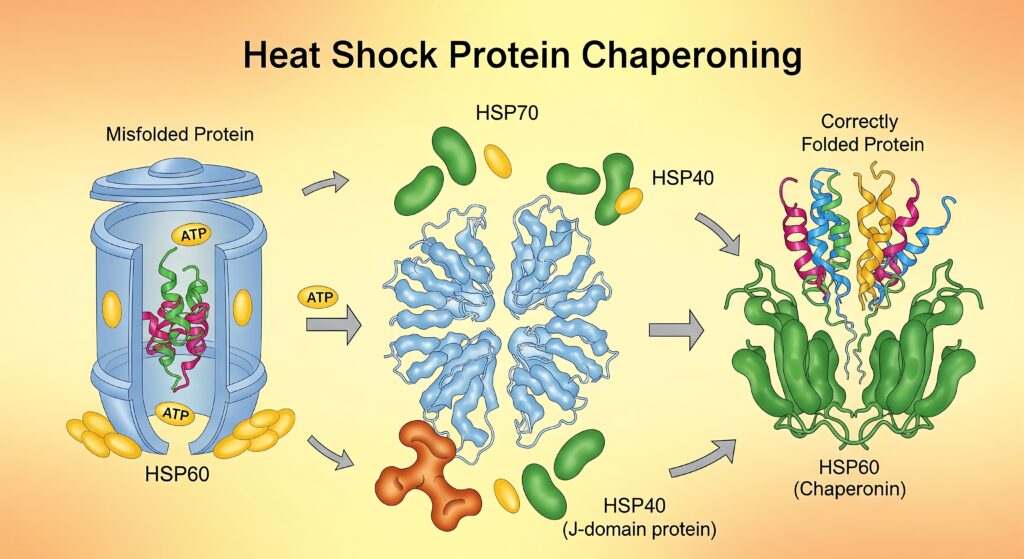
En résumé, les HSP ont besoin d’énergie pour fonctionner.
Les HSPs protègent et réparent les protéines, préservant ainsi l’efficacité cellulaire. Elles maintiennent la fonction mitochondriale, permettant une récupération plus rapide de l’ATP. Leur activité contribue à une récupération physique plus rapide, à une réduction de la fatigue et à un meilleur bien-être général
Les HSPs maintiennent l’homéostasie protéique (protéostasie), qui garantit que les protéines cellulaires sont correctement repliées et fonctionnelles. Sous l’effet du stress, tel que la chaleur dégagée par l’exercice physique, l’exposition à la chaleur ou au froid extérieur ou le stress oxydatif, les protéines peuvent être endommagées ou mal repliées. Les HSPs empêchent ces protéines endommagées de s’agréger et aident à les réparer ou à les éliminer.
En protégeant le mécanisme cellulaire, les HSPs préservent l’efficacité énergétique. Les protéines mal repliées peuvent perturber le métabolisme cellulaire, obligeant les cellules à « travailler plus dur » et à consommer plus d’ATP. Les HSPs réduisent cette demande énergétique supplémentaire.
Pendant la récupération après un stress (par exemple, après une activité physique intense), les cellules subissent une déplétion temporaire en ATP et un stress oxydatif. Les HSPs aident à replier les enzymes endommagées et à stabiliser les protéines mitochondriales, qui sont essentielles à la production d’ATP. En maintenant la fonction mitochondriale, les HSPs favorisent une restauration plus rapide de l’énergie, aidant ainsi les tissus à se rétablir plus efficacement. Rappelons ici que le signal de l’apoptose est donné par les mitochondries.
En plus d’assurer la protection des protéines contre les dommages liés au stress cellulaire, les HSPs soutiennent aussi directement le système immunitaire en favorisant le repliement correct des anticorps. Ce rôle de chaperon garantit que seules des immunoglobulines fonctionnelles sont produites, capables de défendre efficacement l’organisme contre les agents pathogènes. Ainsi, en influençant à la fois la fonction immunitaire et la résilience cellulaire, les HSPs contribuent au maintien des niveaux d’énergie et de la santé générale. Le stress chronique ou le vieillissement peuvent réduire l’expression des HSPs, entraînant une agrégation des protéines, un dysfonctionnement mitochondrial et de la fatigue.

Les HSPs sont des protéines hautement conservées et essentielles. Elles constituent donc une famille universelle de protéines présentes dans pratiquement chez tous les organismes vivants, des bactéries, aux plantes et aux humains.
Chez les plantes, les HSPs jouent un rôle crucial dans la tolérance aux conditions défavorables, notamment la chaleur et la sécheresse. Elles seules permettent aux cellules végétales de maintenir leurs fonctions vitales dans des milieux hostiles.
Le figuier de barbarie (Opuntia ficus-indica), plante emblématique des régions sèches et semi-désertiques, et notamment son fruit la figue de barbarie, illustrent bien cette adaptation. En effet, c’est pendant la saison la plus chaude et aride que le fruit de cette plante murie, mobilisant ainsi un arsenal de protéines de choc thermique, notamment les HSP70, pour protéger ses protéines structurales et enzymatiques. Ces protéines contribuent à la stabilité des membranes cellulaires, à la protection de l’appareil photosynthétique et à la survie de la plante lors de périodes de sécheresse prolongée.
Pour une meilleure compétition au sein d’un biotope chaud, sec et radiatif, les Opuntia (comme toutes les plantes à métabolisme CAM (métabolisme acide crassulacéen) ont répliqué les gènes des HSF et des HSP par polygénie et pour certaines espèces par polyploïdie. Le nombre de gènes fonctionnels est ainsi directement associée à la quantité de motif moléculaire promoteur et répresseur de ces gènes. TEX-OE®, l’extrait de Figue de Barbarie, utilise mes motifs moléculaires donnant un avantage compétiteur de la plante pour une meilleures récupération et restauration.
Les HSPs occupent ainsi une place centrale dans la résilience de la figue de Barbarie, dont les extraits de cladodes, de fleurs, et surtout de fruits, sont riches en composés bioactifs tels que les flavonoïdes, polyphénols, et pigments comme les bétalaïnes. Agissant en synergie avec l’effet protecteur des HSPs, ces composés renforcent la résistance de la plante au stress oxydatif.
Références scientifiques
Recevez chaque mois notre Newsletter pour ne pas manquer notre actualité