L’étude des changements dans la fonction des gènes ayant lieu sans altération de la séquence de l’ADN » constitue l’épigénétique. Ce terme fut introduit pour la première fois en 1942 par Waddington.
L’épigénétique est aussi le mécanisme qui met en musique la lecture des gènes portés par notre ADN. Autrement dit, c’est le mécanisme qui régule l’expression de nos gènes. Tel un chef d’orchestre qui dirige ses musiciens, l’épigénétique régule l’activité des gènes en fonction de l’environnement soit en les activant soit en les inhibant. Quand un gène est activé, on dit qu’il s’exprime, quand il ne s’exprime pas on dit qu’il est réprimé. Le mot « épigénétique » est une métonymie.
Notre corps est composé d’organes qui jouent une rôle grâce à des tissus organisés avec des cellules spécialisées. La cellule est donc la plus petite unité fonctionnelle de notre organisme . Elles sont composées d’un noyau et d’un « cytoplasme » limités par des membranes et dans lesquelles baignent des unités fonctionnelles appelées organites. L’existence même de la cellule repose sur des protéines , suite d’acides aminés dans un ordre et une organisation spatiale définis pour leurs fonctions.
Un gène est un segment d’une grosse molécule appelée ADN consignant sous la forme d’un code « code génétique », la séquence précise des acides aminés codant les protéines de structures comme les collagènes et fonctionnelles comme les enzymes.
Il existe des transformations épigénétiques irréversibles pour l’individu sans modification de l’ADN. L’exemple des abeilles montre que l’épigénétique peut affecter de manière irréversible la totalité d’un individu et sa destinée. Le génome des abeilles d’une ruche provient d’une source identique puisque issu d’une seule fécondation d’une reine. L’alimentation (gelée royale) permettra l’expression des gènes caractérisant la reine et réprimant la transformation en mâle. Chez ces insectes, le facteur permettant la sélection femelle/mâle est mis en place par la communauté des hyménoptères . Une fois établis, les caractères sexuels (phénotype) indispensables au renouvellement de l’essaim sont irréversible.
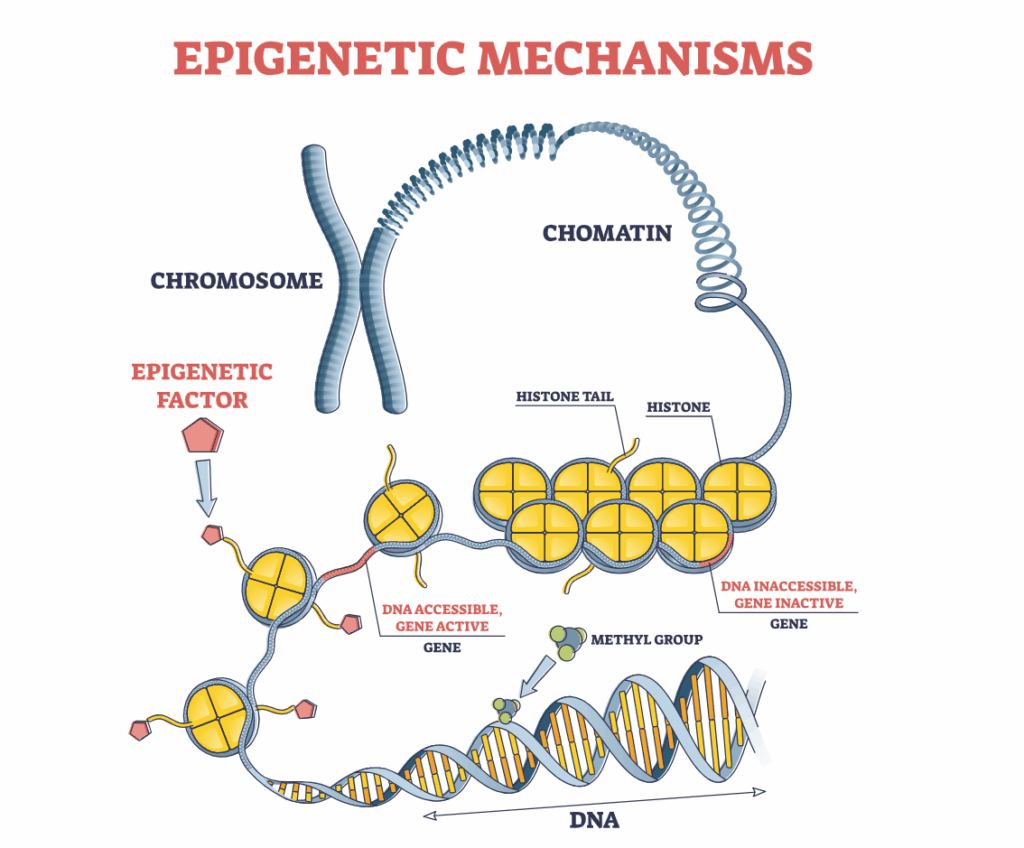
Pour qu’un gène soit activé, il doit pouvoir être lu tout comme une partition de musique. Le rôle de l’épigénétique est donc de réguler l’accessibilité des gènes en jouant sur l’enroulement de l’ADN autour des histones.
Les 3 principaux mécanismes épigénétiques
1. La méthylation de l’ADN : ajout d’un groupe méthyle sur certaines bases de l’ADN, ce qui peut « éteindre » un gène. Cette modification peut être réversible bien qu’elle modifie chimiquement l’ADN sans en altérer la séquence. Ces modifications ne sont pas transgénérationnelles.
2. Les modifications des histones : les histones sont des protéines comme des cabestans, autour desquelles l’ADN s’enroule; leur modification influence la compaction de l’ADN et donc l’accès aux gènes. Il existe quatre types majeurs de modifications adaptatives des histones: l’acétylation, la méthylation, la phosphorylation et l’ubiquitinylation.
3. Les ARN non codants : ils peuvent interagir avec l’ADN ou l’ARN pour réguler l’expression génétique.
L’ADN (ou acide désoxyribonucléique) est une molécule constituée d’une succession d’environ 3 milliards de bases dites azotées, qui, mesurerait près de 2 mètres de long si on la déroulait. Il existe 4 sortes de bases azotées : A pour adénine, T pour thymine, G pour guanine et C pour cytosine où chaque individu possède une suite de bases unique. Ce code unique de l’information génétique d’une personne constitue son génome.
Les gènes sont des portions de l’ADN ayant une fonction bien définie. Ils sont lus par des enzymes pour permettre la fabrication de protéines, des molécules qui constituent et font fonctionner tout organisme vivant.
On retrouve cette grande molécule d’ADN dans les chromosomes organisés en paires dans le noyau des cellules. Chez l’être humain, on compte 23 paires de chromosomes contenues dans le noyau de chaque cellule de notre corps. Ainsi, l’ensemble de nos cellules contient la même molécule d’ADN. Pourtant, pour faire un corps fonctionnel, il faut des types de cellules différents : des cellules de cœur, des cellules de peau, des neurones,… C’est donc là qu’intervient l’épigénétique en régulant l’expression de nos gènes. Si toutes les cellules contiennent le même génome, toutes n’expriment pas pour autant les mêmes gènes.
Comme toute machinerie, elle peut parfois se dérégler. Notre environnement et notre hygiène de vie peuvent influencer le fonctionnement de nos marques épigénétiques. Le dérèglement de l’épigénétique désigne un déséquilibre ou une altération des mécanismes épigénétiques qui régulent l’expression des gènes sans modifier la séquence de l’ADN. Ces dérèglements peuvent perturber le fonctionnement normal des cellules et sont souvent associés à des maladies comme le cancer, certaines maladies neurodégénératives, des troubles métaboliques ou encore des maladies auto-immunes.
4 Exemples de Dérèglement épigénétique
1. Un dérèglement épigénétique peut survenir lors d’une Hyperméthylation anormale des gènes suppresseurs de tumeurs. Les gènes suppresseurs de tumeurs (comme p53, BRCA1, etc.) ont un rôle crucial : ils empêchent la multiplication incontrôlée des cellules. En temps normal, ces gènes sont actifs : ils freinent la division cellulaire, réparent l’ADN ou déclenchent la mort de cellules anormales. Lors d’un dérèglement épigénétique, certains de ces gènes peuvent subir une hyperméthylation (ajout excessif de groupes méthyles sur leur ADN, surtout dans les régions promotrices). Cette hyperméthylation « éteint » leur expression, ce qui désactive leur fonction protectrice. Ainsi, les cellules peuvent se diviser sans contrôle et entraîner le développement de tumémeurs.
2. Hypométhylation globale de l’ADN. En situation normale, certaines parties de l’ADN, notamment les séquences répétitives ou inutiles, sont fortement méthylées pour rester silencieuses. En cas de hypométhylation globale (manque général de méthylation dans le génome), ces régions peuvent devenir actives alors qu’elles ne devraient pas l’être et entraîner :
Altérations des histones. L’ADN est enroulé autour de protéines appelées histones, formant un complexe appelé chromatine. Ces histones peuvent subir des modifications chimiques (acétylation, méthylation, phosphorylation, etc.). Ces modifications influencent la structure de la chromatine :
Un dérèglement de ces modifications peut donc 1/activer des gènes qui ne devraient pas l’être et 2/ Réprimer des gènes essentiels (comme les gènes de réparation de l’ADN).
4. Perturbations dans les ARN non codants. Les ARN non codants (comme les microARN ou les longs ARN non codants) ne produisent pas de protéines, mais régulent l’expression des gènes. Les microARN par exemple peuvent bloquer la traduction d’un ARN messager ou le dégrader. Si ces ARN sont surrégulés ou sous-régulés :
Ces types de dérèglement sont impliqués dans de nombreux cancers et maladies neurodégénératives.
Pour un exemple détaillé voir à la fin du document
3 faits fascinants sur l’épigénétique
1. “Vous êtes ce que votre père mange”
Il est bien établi que les femmes enceintes doivent consommer des quantités suffisantes de folate (également appelé acide folique ou vitamine B9) afin de réduire les risques de fausses couches et de malformations congénitales. Ce nutriment joue un rôle essentiel dans le processus de méthylation de l’ADN, un mécanisme qui régule l’expression normale des gènes.
Pour la première fois, des chercheurs de l’Université McGill à Montréal (Québec, Canada) ont démontré que cet aspect de l’alimentation ne concerne pas uniquement la mère. En effet, ils ont découvert que l’apport en folate chez le père peut également influencer la santé et le développement de l’enfant à naître.
(https://www.nature.com/articles/ncomms3889)
2. “L’exercice physique affecte l’épigénétique”
L’exercice physique induit des schémas de méthylation différents dans les gènes associés à la régulation du métabolisme cellulaire des glucides et au remodelage structurel, ce qui a suggéré aux chercheurs d’une étude de 2014 que les changements transcriptionnels dans le muscle squelettique dus à l’exercice physique sont liés aux changements de méthylation de l’ADN.
(https://www.tandfonline.com/doi/full/10.4161/15592294.2014.982445)
3. « Il existe une horloge épigénétique »
L’analyse d’une grande variété d’échantillons de tissus prélevés sur un grand nombre de personnes (13 000) d’âges différents a révélé une évolution de l’ADN méthylé en corrélation avec l’âge. L’horloge épigénétique (ou epigenetic clock en anglais) se définit comme un outil biologique qui permet d’estimer l’âge biologique d’un individu, en se basant sur les modifications épigénétiques de son ADN, notamment la méthylation de l’ADN.
(https://www.nature.com/articles/508168a)
PLUS EN DETAIL – Un exemple d’Epigénétique
L’exemple le plus illustratif des modifications épigénétiques est celui de la différenciation cellulaire. Ainsi, au cours de la morphogenèse, une seule cellule diploïde (œuf fertilisé ou zygote) va se diviser en plusieurs cellules qui à leur tour vont se différencier en plusieurs types cellulaires comme les neurones, les cellules musculaires, les cellules cardiovasculaires etc. et ceci en activant certains gènes et en inhibant d’autres.
Le remodelage de la chromatine est considéré comme le facteur épigénétique majeur responsable de la régulation de l’expression génique sans altération des séquences d’ADN. La chromatine est un complexe formé de chaines d’ADN enroulées sur des sphères protéiques (histone). Il est donc évident que si cette association entre l’ADN et l’histone change ; l’expression génique change aussi. Ce remodelage de la chromatine est effectué via 2 mécanismes essentiels :
1- Les modifications pst-traductionnelles des protéines de l’histone comme l’acétylation et la méthylation des acides aminés.
2- La méthylation de l’ADN et notamment de la cytosine en 5-méthylcytosine à l’aide de DNA méthyltransférase (DNMT-1). Ainsi, certaines zones le long de la chaine nucléotidique montrent un degré de méthylation plus élevé que d’autres. Il est à noter que les gènes hyperméthylés sont moins transcrits que les gènes pas ou légèrement méthylés.
Suivant les zones de la chromatine où les modifications épigénétiques sont opérées, les gènes situés à ce niveau seront plus ou moins activés selon le type du mécanisme épigénétique [(dé)méthylation et/ou (dés) acétylation] mis en œuvre. Ainsi la désacétylation de l’histone et la méthylation de l’ADN vont doter la chromatine d’une structure plus compacte moins accessible à l’enzyme de transcription ; RNA polymérase avec comme conséquences l’arrêt ou le ralentissement de l’expression génique. En revanche, l’acétylation de l’histone et la déméthylation de l’ADN contribuent à desserrer les liens entre l’ADN et l’histone facilitant l’accès à l’enzyme de transcription.
Il est donc clair que les facteurs épigénétiques sont des facteurs clé pouvant jouer un rôle décisif dans l’orientation de l’activité d’une cellule (différenciation et transformation) en favorisant ou en inhibant l’expression de certains gènes déterminant ainsi son phénotype. Il est à noter que la méthylation de l’ADN est un processus essentiel au cours du développement embryonnaire et dans les cellules somatiques car il permet de réguler l’expression génique d’une manière temporellement et spatialement-dépendant. Cependant, des schémas aberrants de (dé)méthylation d’ADN sont associés à des malignités humaines en comparaison avec des tissus normaux et notamment dans les zones où sont localisés les gènes suppresseurs de tumeurs. L’hyperméthylation de ces zones a pour effet d’inhiber l’expression de ces gènes et notamment p53.

Recevez chaque mois notre Newsletter pour ne pas manquer notre actualité